聊一聊抗药物抗体到底是什么?
点击蓝字 关注我们

单抗疗法可以有效地治疗许多疾病,如癌症、移植排斥、自身免疫和感染性疾病。目前有超过70种单抗获得美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)的批准,还有数百种处于临床开发各阶段,总潜在市场价值达到1000亿美元。
与小分子药物相比,mAb具有明确的靶标和特异性的作用机制,具有更好的安全性和有效性。但它们也可能被受体识别为异物,从而引发不良的免疫反应。主要表现之一就是抗药物抗体(ADA)的产生。
Pfizer公司的降脂药物bococizumab的失败就是一个警示,bococizumab在很大比例的患者中生成ADA,显著减弱其降低胆固醇的水平,使得该计划花费数亿美元后被迫结束。随着需求的增加,更精确地评估单抗治疗的耐药机制和免疫原性十分必要。由于患者就诊次数较多、治疗疗程长、依从性低、伴随治疗、先天和/或适应性免疫反应等各种机制的影响,由此产生的免疫反应不仅会导致疗效下降,还会引发血清病、细胞因子释放综合征(CRS)、急性过敏反应(IgE介导)和肿瘤溶解综合征(TlS)。
ADAs的产生机制最初与首次开发上市的mAb含有小鼠序列有关。它们被人体免疫系统识别为异物,导致免疫原性(图1)。为克服这一问题,生物工程连续成功开发了嵌合(小鼠-人)抗体、人源化抗体和全人源抗体。尽管免疫原性有所下降,但尚未完全消除,ADAs可以在所有类型的mAb中出现,其产生涉及不同途径的免疫系统刺激,适应性和非适应性免疫应答都可能参与其中。
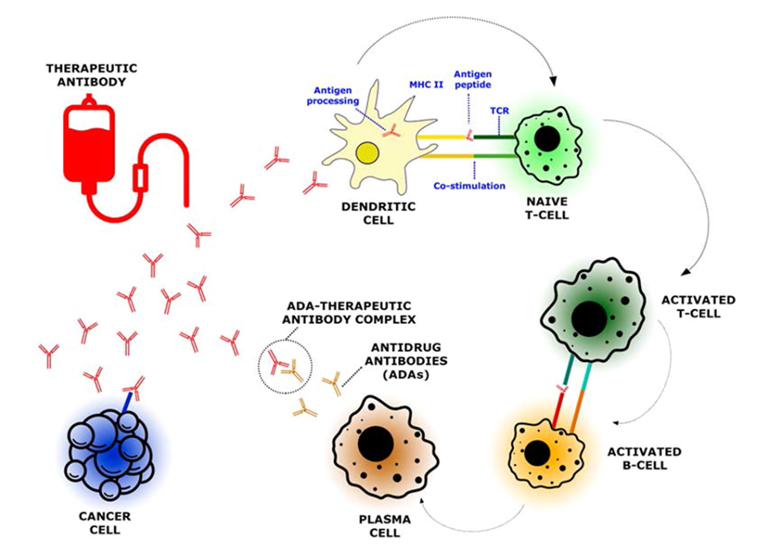
图1 抗药物抗体的产生机制和与机体的相互作用
ADA的合成与人类白细胞抗原(HLA)和主要组织相容性复合体(MHC)有关。ADA可由T淋巴细胞依赖性或非依赖性途径产生。T依赖性途径中mAb作为抗原,通过抗原呈递细胞被内化,再经MHC II类分子和T细胞受体之间的相互作用被处理并呈递给T细胞,辅助性T细胞随后与B细胞接触,诱导其增殖分化为浆细胞,浆细胞合成和分泌针对mAb的特定ADA。相比之下,T非依赖性途径涉及多个表位,这些表位本身可以与B细胞受体相互作用,刺激它们分化成浆细胞以合成ADA。
ADA通常发生在第一次药物输注期间。最常见的是初始低亲和力和非中和IgM应答,其次是高亲和力和中和IgG1和IgG4应答。与ADA形成相关的因素包括患者遗传学、合并症、免疫状态、伴随治疗和其他药物。此外,还包括mAb的剂量、给药途径、治疗时间、生物学结构、配方、储存以及污染物和杂质等。
ADA能够与mAb相互作用,影响其药动学和药效学特性,降低其疗效。一方面,如果ADA导向至抗原结合位点,则mAb-ADA复合物将不具有生物活性,从而导致mAb的药效学特性改变;另一方面,mAb和ADA之间形成的免疫复合物的大小和组成有所不同,这会加速肝和脾捕获它们并激活免疫系统和刺激药物清除。由于这些原因,ADAs可引起药物原发性或继发性耐药性,影响治疗效果。
为了降低ADAs的发生率,mAb疗法通常以高剂量给药以使患者耐受。图2展示了ADA的安全性和有效性问题。
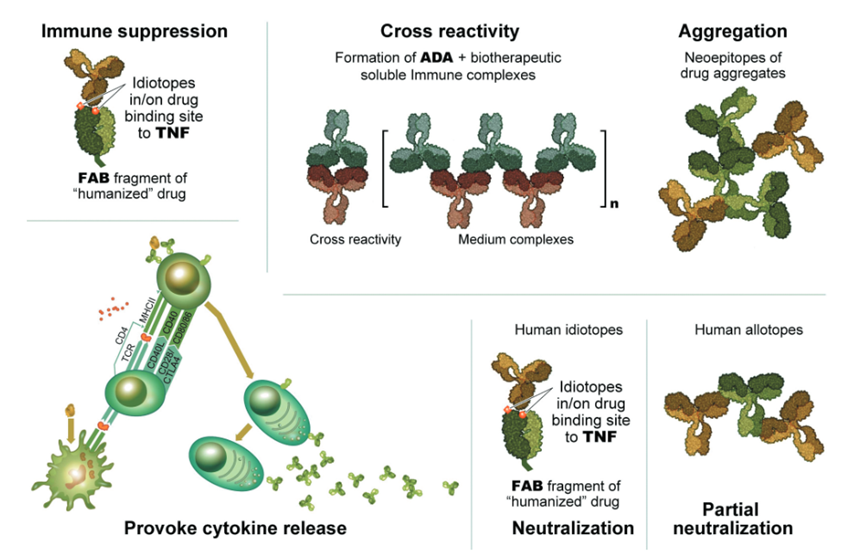
图2抗药物抗体的安全性和有效性问题
在全球范围内,ADA的出现是终止将新分子从动物模型转化到临床试验的重要原因之一,因此FDA和EMA发布指南,要求在开发过程中必须检测潜在的免疫原性。
ADA的鉴定常用两种方法:(1)免疫反应性实验,检测ADA与治疗药物的结合;(2)中和实验,用于识别中和抗体(Neutralizing antibody,nAb)。该过程使用敏感的免疫反应性试验进行筛选,然后使用具有高特异性的免疫反应性试验进行确认,通过评估抗体的中和能力来表征ADA (图3)。
图3(A) 基于酶联免疫吸附试验( enzyme-linked immunosorbent assay,ELISA )是一种高灵敏检测ADA的免疫反应性试验,当与ADA结合时,会发生颜色反应。(B)基于细胞的试验是中和抗体(nAb)试验的一种,如果存在nAb,由于治疗药物无法与其靶标结合,检测反应受到抑制。(C)免标记生物传感器具有高度特异性,能将刺激诱导的细胞反应转化为可量化的信号,可检测低亲和力抗体,常用于ELISA或RIPA筛选后的分析。

图3目前用于ADA检测的方法
ADA检测的局限性常常导致单抗治疗的安全性和有效性不确定。目前FDA建议开发灵敏度、特异性、选择性、精密度、重现性和稳健性优化的检测方法,以提高临床试验期间对治疗性蛋白免疫原性的评估。还建议初期筛选试验应能够检测所有相关的同型免疫球蛋白。
FDA指导建议,从发现到临床监测的整个单抗治疗过程中都应检测ADAs(图4)。鼓励在早期试验中使用合适的检测方法,并在申请许可时提供数据支持对检测方法进行全面验证。此外,应考虑特异性,如从一个患者群体转移到另一个患者群体时需要谨慎,并对新患者群体进行新的风险评估,这些考虑对于监测患者安全和药物疗效非常重要。
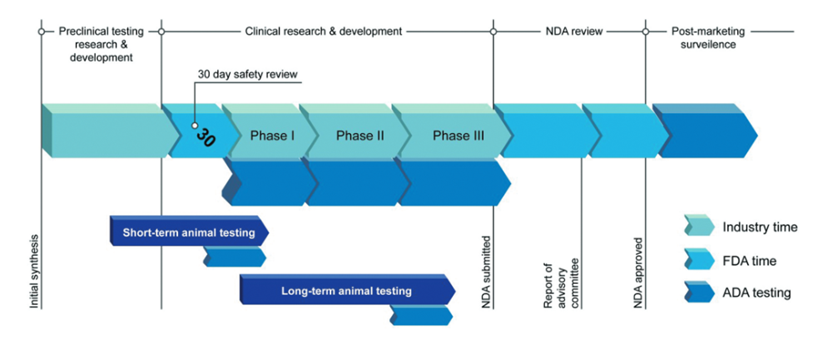
图4药物开发阶段以及确定在哪里可以添加ADAs来改进工艺
每个人都有独特的免疫系统,个体的单倍型决定免疫反应水平,也会影响B细胞的活化,导致产生ADA。因此对患者的单体型研究免疫原性十分重要。此外也需要更多的研究来确定哪些患者在接受特异性单抗治疗时会发生ADA,如接受自身免疫性疾病单抗治疗的患者,如果表达特定的HLA,可能更容易发生ADA。这些考虑可以为更个性化的医疗提供帮助。
ADA的产生是异质性的,即使是全人源的单抗治疗也有可能产生ADA。通过高信息量的分析,个性化医疗可以纳入ADA研究和药物开发。未来的ADA可以通过遗传图谱进行预测和研究。
为降低mAb免疫原性开发了全人源或人源化抗体。与鼠或人嵌合单克隆抗体相比,其诱导 ADA 的风险降低;通过蛋白质工程从生物制剂中去除T细胞和B细胞表位,通过限制 B 细胞活化来减轻其免疫原性;终产品的翻译后修饰和配方中辅料选择也有可能改善治疗性抗体的免疫原性。
一些数据表明,由于化疗的免疫抑制效应,化疗和免疫治疗的组合可能会减少ADA的产生。在临床试验中正在测试皮质类固醇和免疫疗法的组合。这种疗法在具有自身免疫的疾病,如克罗恩病,被证明是有益的。此外,基于一些风湿病研究中甲氨蝶呤等药物对ADA产生抑制的相同的免疫抑制原理,一些早期肿瘤临床试验正在使用抗CD20奥妥珠单抗和抗IL-6托珠单抗作为治疗前用药。
来源 | 医药速览
编辑 | Joy
(版权归原作者所有,如有侵权,联系小编删除)
小提示:87%用户已下载掌上医讯App,更方便阅读和交流,请扫描二维码直接下载App

(本网站所有内容,凡注明来源为“掌上医讯”,版权均归掌上医讯所有,欢迎转载,转载请注明出处,否则将追究法律责任。凡是本网站注明来源为其他媒体的内容为转载,版权归原作者所有,转载仅作分享,文章观点不作为掌上医讯观点,如有侵权,请及时联系我们,联系电话:0532-67773733)

